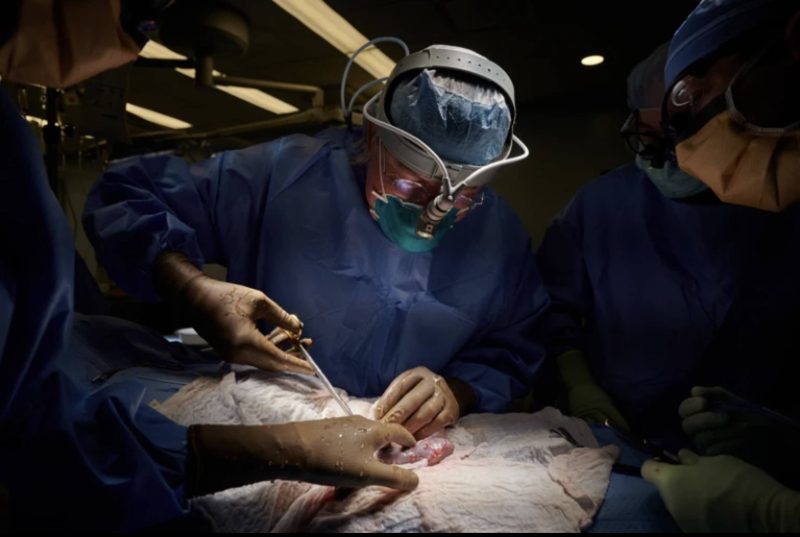
L o scorso 7 gennaio David Bennett, 57 anni, si sottoponeva a una procedura definita “un salto nel buio”. Il suo cuore, affetto da una grave aritmia che lo avrebbe condotto a morte certa, veniva separato dal suo corpo. Al suo posto, veniva trapiantato il cuore di un maiale modificato geneticamente.
L’operazione è stata la prima del suo genere; il punto di arrivo di un lungo percorso di ricerca, ma anche il primo passo di una nuova strada, in gran parte oscura. A portarla a termine è stato Bartley P. Griffith, professore di chirurgia dei trapianti all’Università del Maryland, mentre il responsabile scientifico del progetto era Muhammad M. Mohiuddin, professore di chirurgia nello stesso ateneo. Il team aveva già trapiantato dei cuori di maiale in alcuni babbuini.
Nel caso di Bennett la procedura è dovuta passare per l’approvazione della Food and Drug Administration (FDA) americana, che ha dato il via per l’uso compassionevole, ovvero quello per un paziente senza altre possibilità di sopravvivenza. La funzionalità cardiaca dell’uomo, infatti, prima del trapianto, era supportata da una macchina ECMO per la circolazione extracorporea, che provvedeva alla circolazione e ossigenazione del sangue, attività che il suo sistema cardiopolmonare non era più in grado di svolgere. L’unica vera soluzione era un trapianto, ma le liste di attesa per un cuore umano sono lunghe, spesso carenti di organi e regolate da rigorosi protocolli di selezione, protocolli che avevano escluso Bennett per le sue gravi condizioni generali e la difficoltà di poter seguire le indicazioni dei medici. Bennett, allora, aveva scelto coscientemente l’altra opzione.
Il cuore ricevuto dal paziente apparteneva a un maiale il cui DNA era stato ingegnerizzato con dieci mutazioni: nove avevano lo scopo di favorire la compatibilità immunologica tra organo e ricevente, una rendeva il cuore insensibile all’ormone della crescita, perché non crescesse oltre le dimensioni necessarie. Con questo nuovo cuore, David Bennett è sopravvissuto per due mesi. Può sembrare ben poco nell’ottica della vita di una persona; tuttavia, dal punto di vista della ricerca, delle prospettive di cura rappresentate da questo intervento, si tratta di un grande successo. All’autopsia, infatti, il cuore non mostrava i segni ordinari di rigetto.
Lo xenotrapianto è una procedura che ha il potenziale di salvare milioni di persone in attesa di un organo: soltanto in Italia sono 9 mila.
Rimangono molte domande a cui rispondere. Il trattamento immunosoppressivo (necessario per ridurre l’attività del sistema immunitario durante i trapianti d’organo) che Bennett ha ricevuto era anch’esso sperimentale: era davvero il migliore possibile? E quante delle dieci mutazioni del DNA del maiale erano effettivamente necessarie? Soprattutto, quali sono le cause della morte di Bennett? Le risposte non sono certe. Nel sangue di Bennett sono state trovate tracce del DNA di un citomegalovirus porcino, arrivato con il trapianto nonostante le precauzioni: sono virus presenti nelle cellule di maiale, innocui in questi animali ma che possono infettare le cellule umane e rappresentare un pericolo per la salute dei pazienti. Tuttavia non è neanche sicuro che il virus abbia avuto un ruolo nella morte dell’uomo; secondo alcuni medici, le sue condizioni erano semplicemente già troppo gravi.
Quel che è certo è che il signor Bennett, insieme ai medici e ricercatori che hanno seguito il progetto, sono stati pionieri di una procedura, lo xenotrapianto – il trapianto eseguito con l’utilizzo di organi prelevati a esseri viventi di una specie diversa da quella del ricevente – che ha il potenziale di salvare milioni di persone in attesa di un organo: soltanto in Italia sono 9 mila.
Un’antica chimera
Facciamo un passo indietro. Gli esseri umani fantasticano da millenni di unire specie diverse in uno stesso corpo. Basta pensare alle creature metà uomo e metà animale con cui i greci popolavano i propri miti o agli dèi con teste animali raffigurati sulle tombe egizie. Meno conosciuti sono gli ibridi di altre tradizioni: come Anansi, divinità africana custode di storie e conoscenza, che è dipinto spesso come un ragno con testa di uomo. Oppure i Lamassu, creature con corpi di leoni o tori alati e barbuti visi umani che le popolazioni mesopotamiche ponevano a guardia dei propri palazzi. Proprio un Lamassu è stato il simbolo dell’Associazione Internazionale per gli Xenotrapianti fino al 2014, quando è stato sostituito da un più sobrio logo a forma di X.
La realtà dello xenotrapianto ha ovviamente ben poco a che fare con queste figure mitologiche; ma le sue radici, sebbene non così antiche, affondano comunque in un lontano passato. Uno dei più antichi resoconti dell’utilizzo di tessuti animali risale infatti al 1682, riportato nell’Observationes Medico-Chirurgicae dal chirurgo olandese Job Janszoon van Meekeren. Riferiva di un nobile russo che aveva perso parte di scalpo e cranio per un colpo di spada; la sua ferita era stata riparata con parti del cranio di un cane, “rattoppo” poi rimosso perché il nobile, con parti di cane nel corpo, non veniva più fatto entrare in Chiesa e rischiava la scomunica.
Il resoconto ha ben poco di scientifico e va preso con le pinze (il chirurgo aveva sentito la storia da un amico teologo, che l’aveva sentita da un collega russo). E non sarebbe stato comunque uno xenotrapianto in piena regola, essendo ragionevole (e augurabile) pensare che quello usato fosse il teschio di un cane morto da tempo. Ma mostra comunque come idee simili ronzassero da tempo nelle menti di alcuni medici, ed esemplifica le diffidenze che queste procedure incontrano da sempre.

Nel Diciannovesimo secolo si diffuse la pratica di innestare su pazienti ritagli di pelle animale (preferibilmente, ma non necessariamente, priva di peli). Talvolta si tardava a separare completamente l’innesto dal donatore animale per mantenerlo vascolarizzato, praticando quel che si dice un innesto peduncolato: per fare questo l’animale, ad esempio una pecora, andava tenuto legato al paziente per giorni. Anche senza toccare gli aspetti etici di queste procedure, è indubbio che non ebbero alcun successo.
Ben più influente fu l’operazione con cui Richard Kissam, nel 1838, impiantò una cornea di maiale su di un paziente cieco; l’intervento fallì, ma fu il precursore del trapianto di cornea da uomo a uomo, tentato solo nel 1905 e oggi comunemente praticato. Un altro pioniere fu Serge Voronoff, che a inizio Novecento ebbe l’idea di trapiantare cellule secernenti un ormone in pazienti in cui l’ormone è deficitario, oggi alla base di studi che sperano di curare pazienti diabetici e con Parkinson. Ciò che fece Voronoff, per la precisione, fu impiantare sezioni di testicolo di scimpanzé o babbuino nei testicoli di uomini anziani. La procedura, per quanto inefficace, acquisì una certa popolarità.
Una svolta arrivò grazie al premio Nobel per la medicina del 1912, Alexis Carrel, padre delle tecniche di anastomosi vascolare (le procedure con cui i vasi vengono collegati l’uno all’altro mantenendo il flusso all’interno) che hanno consentito il decollo della trapiantologia in generale. Nonostante le nuove tecniche, gli xenotrapianti degli anni seguenti furono ancora fallimentari.
A partire da Jaboulay nel 1906, diversi chirurghi tentarono di trapiantare reni animali; il successo maggiore fu il caso di un paziente operato da Keith Reemtsma, che negli anni Sessanta sopravvisse per nove mesi con un rene di scimpanzé. Nel 1964, James Hardy tentò il primo xenotrapianto di cuore, che fallì perché l’organo di scimpanzé utilizzato si rivelò troppo piccolo per il ricevente umano. Il tentativo del genere più famoso fu quello di Baby Fae, infante nata nel 1984 con una malformazione cardiaca; fu operata da Leonard Bailey e ricevette un cuore di babbuino, con cui sopravvisse per venti giorni.
Uno dei più antichi resoconti dell’utilizzo di tessuti animali risale al 1682, riportato nell’Observationes Medico-Chirurgicae dal chirurgo olandese Job Janszoon van Meekeren.
L’interesse per gli xenotrapianti calò negli anni Novanta, con la scoperta dei retrovirus porcini: la minaccia che questi virus si trasmettessero all’uomo si inserì pesantemente nel dibattito etico di una procedura già dibattuta. In parallelo, l’ascesa delle ricerche sulle cellule staminali attirò l’attenzione della comunità scientifica.
Rigetto per l’estraneo
Il nostro corpo, per mezzo del sistema immunitario, reagisce violentemente contro gli intrusi: è questo il motivo principale per cui i tentativi fatti in passato di sostituire un organo umano con uno animale continuavano a fallire. Ma in che modo succede?
Prima responsabile è una reazione detta rigetto iperacuto. Compare dopo poche ore o persino minuti dall’intervento ed è causato da anticorpi che, legandosi alle cellule dell’organo trapiantato, finiscono per causarvi micro-trombi ed emorragie, fino al suo fallimento irreversibile.
Normalmente, però, perché si generi una reazione mediata da anticorpi, dobbiamo essere sensibilizzati, ovvero deve esserci stato un contatto precedente con l’antigene in causa: il contatto ha l’effetto di selezionare, e far riprodurre in massa, gli anticorpi capaci di legarvisi tra le milioni di varianti che il nostro corpo produce. Questo è quanto succede quando ci vacciniamo, per esempio. Com’è possibile però che un organo animale, un tessuto estraneo e mai incontrato prima, causi reazione così in fretta?
Attori di rilievo nel rigetto iperacuto sono anticorpi rivolti contro un antigene detto α-gal; è presente sulle cellule della maggior parte dei mammiferi, ma non sulle nostre, né su quelle dei nostri parenti più stretti (scimpanzé, oranghi e gorilla). Essendo privi dell’antigene, non sviluppiamo tolleranza verso di esso (quel fenomeno per cui il sistema immunitario di un individuo, normalmente, non reagisce contro gli antigeni del suo stesso corpo); non avendo tolleranza per α-gal, produciamo gli anticorpi che lo legano, i cosiddetti anti-gal, in risposta principalmente ad alcuni batteri che colonizzano il nostro tratto gastro intestinale sin dall’infanzia. Si stima che fino all’1% del totale dei nostri anticorpi siano anti-gal, cosa che rende gli organi di animali come il maiale assolutamente sgraditi ai nostri corpi. A meno che, come nel caso del cuore geneticamente modificato ricevuto da David Bennett, il gene per la produzione di α-gal sia deleto.
Il rigetto iperacuto, però, non è l’unica barriera immunologica: se anche l’organo riesce a passare la prima giornata, si può presentare il rigetto acuto, da pochi giorni ad alcune settimane dopo l’intervento, o il rigetto cronico, che arriva dopo mesi o anche anni. Sarebbe più facile, immunologicamente parlando, usare gli organi di scimmie antropomorfe come scimpanzé, oranghi e gorilla.
“Il maiale è eticamente più accettabile di un primate”, mi spiega però il professor Emanuele Cozzi, responsabile dell’Unità Operativa semplice dipartimentale di immunologia dei trapianti dell’Azienda Ospedale-Università di Padova, presidente del Comitato europeo per i trapianti d’organo ed ex presidente dell’Associazione Internazionale per gli Xenotrapianti. “Siamo attrezzati per il suo allevamento, è disponibile in grandi numeri e cresce velocemente, fatto necessario perché gli organi siano disponibili in tempi rapidi. In più, maiale e uomo hanno molti punti di compatibilità fisiologica”.
Il nostro corpo, per mezzo del sistema immunitario, reagisce violentemente contro gli intrusi: è questo il motivo principale per cui i tentativi fatti in passato di sostituire un organo umano con uno animale hanno continuato a fallire.
Non è questa la prima volta che il maiale viene usato per sopperire esigenze fisiologiche di base dell’uomo. “Cento anni fa non esisteva l’insulina ricombinante umana che usiamo oggi, il diabete veniva curato con insulina di maiale”, spiega ancora Cozzi.
Già nel 1907 Carrel scriveva: “Il metodo ideale sarebbe trapiantare nell’uomo organi di animali facili da procurarsi e operare, come il maiale, ad esempio. Ma in tutta probabilità sarebbe necessario immunizzare gli organi del maiale contro il siero umano.” Ed è proprio a questo punto che è arrivata la medicina moderna.
Una barriera in meno
Il caso di Bennett non è isolato. Due gruppi diversi di ricercatori, guidati da Robert Montgomery e Paige Porrett, hanno compiuto i primi trapianti di rene suino geneticamente modificato in pazienti cerebralmente morti. Montgomery e colleghi hanno portato a termine due di questi trapianti a settembre e novembre 2021, senza asportare i reni del ricevente, e monitorato i risultati per 54 ore. La prova di Porrett e colleghi è avvenuta nel gennaio di quest’anno, è durata 74 ore e ha visto l’asportazione dei reni del ricevente. In tutti i casi la reazione immunitaria è stata minima e il paziente produceva urina, sebbene quello di Porett avesse una funzionalità renale deficitaria in alcuni aspetti chiave.
Per di più, medici della New York University hanno affermato, in una conferenza stampa, di avere trapiantato cuori di maiali in due pazienti cerebralmente morti a giugno e luglio di quest’anno; gli esperimenti, durati tre giorni, non avrebbero evidenziato segni di rigetto. I loro risultati, tuttavia, non sono ancora stati pubblicati nelle riviste di settore. “Dobbiamo mettere insieme i dati di tutti i casi”, dice il professor Cozzi. “Prima, tutto ciò che sapevamo era costruito in laboratorio su modelli preclinici, da maiale a primate non umano. Non sapevamo con sicurezza come questi dati si sarebbero tradotti nell’uomo. Queste esperienze mi dicono che la barriera del rigetto iperacuto si può considerare sconfitta, nessun dubbio su questo”.
I risultati ottenuti hanno portato recentemente la FDA ad aprire alla possibilità dei primi trial clinici sugli xenotrapianti. Anche in Europa si fa ricerca a riguardo: secondo Cozzi diversi centri specialistici, specialmente in Francia e Germania, hanno le potenzialità per fare il salto dagli studi sui modelli preclinici agli studi clinici, su pazienti.
E in Italia? Attualmente non ci sono studi, nemmeno a livello preclinico, sugli xenotrapianti. La legislazione italiana certo non stimola la ricerca: la nostra legge è più rigida di quella europea, e vieterebbe l’utilizzo di animali negli studi su xenotrapianti e sostanze d’abuso. Tuttavia, l’applicazione di questa legge è stata più volte prorogata, attualmente fino al 2025. Se le ricerche non sono vietate, sono quanto meno scoraggiate, perché intraprenderle vorrebbe dire investire tanto su un futuro incerto.
Vite animali, etica umana
La legge italiana è figlia delle apprensioni che lo xenotrapianto ha suscitato sin dalla sua concezione, timori che di rado riflettono la reale complessità del dibattito bioetico sull’argomento. Marco Annoni, ricercatore in bioetica presso il CNR, è coordinatore del comitato etico della Fondazione Veronesi e autore di diversi libri. Mi racconta: “La bioetica esiste all’intersezione tra progresso scientifico e questioni morali: nel caso dello xenotrapianto, le più grosse sollevate sono tre. La prima questione morale è quella del benessere umano, per cui è necessaria una valutazione di rischio e beneficio. Dobbiamo considerare non solo come utilizzare la procedura se questa funziona, ma soprattutto come gestire l’incertezza delle prime sperimentazioni su soggetti umani.”
In questa valutazione, hanno particolare importanza i retrovirus porcini, e il rischio che questi si trasmettano all’uomo. Gli esperti sono da anni al corrente del problema, e vengono attuate rigide precauzioni perché gli organi utilizzati non siano infetti; come il caso di Bennett dimostra, però, gli incidenti possono accadere. Anche per valutare eventuali trasmissioni, sia i pazienti che i loro familiari andrebbero sottoposti a controlli medici essenzialmente per tutta la vita. Ma questo, secondo Annoni, pone un altro quesito morale: hanno queste persone il diritto di ritirarsi dagli studi?
“La seconda grossa questione è quella della ricerca: una sperimentazione come quella dello xenotrapianto, a prescindere dai benefici pratici, può sempre portare a conoscenze e progressi rilevanti. Come sappiamo, la ricerca procede spesso in maniera serendipica, e sapere come manipolare cellule, tessuti e organi di altri animali può risultare di per sé una conoscenza che vale la pena acquisire”.
Se è vero che non sappiamo sempre dove ci può portare la ricerca, è anche vero che non possiamo intraprendere ogni percorso possibile. Ogni potenziale avanzamento, per essere sviluppato, necessita di grandi investimenti tra strutture, specialisti, brevetti e non solo. “Una volta che un percorso di ricerca diventa la piattaforma di riferimento è difficile tornare indietro, diventa lo standard”, ha detto Annoni. “Dobbiamo ragionare molto bene all’origine su cosa investire, e farci le domande giuste”.
Molte di queste domande hanno a che fare con la terza questione, quella del benessere di animali diversi dall’uomo. “Il dibattito ha avuto un avanzamento recente, con il libro Principles of Animal Research Ethics del 2020”, mi spiega Annoni. “In esso, gli autori tentano di superare il paradigma delle tre R, reduction, refinement, replacement, ovvero riduzione, perfezionamento e sostituzione”.
Le tre R stabiliscono che i ricercatori devono, per quanto possibile, ridurre il numero di animali utilizzati, perfezionarne le condizioni massimizzando la loro qualità di vita, rimpiazzarli con altri modelli se non sono indispensabili. Questi principi furono formulati nel The Principles of Humane Experimental Technique del 1959, e sono i più ampiamente accettati al momento. “Il paradigma delle tre R ha un grosso limite: non porta mai a chiedersi se l’esperimento sia davvero necessario. Secondo me è questa la domanda morale fondamentale, che ogni percorso di ricerca dovrebbe farsi e tenere sempre in superficie”, secondo Annoni.
A differenza di altri studi, poi, lo xenotrapianto non usa moscerini della frutta o nematodi come C. elegans, ma i maiali. “Con le conoscenze attuali, è difficile negare che i maiali siano animali senzienti, con una complessa vita individuale”, mi spiega. “Viene fatta la contro argomentazione che possiamo trovare animali e parti di animali in ogni supermercato; è vero che già trattiamo milioni di animali in una maniera che ritengo non sia eticamente sostenibile, ma questo non elude la domanda morale fondamentale”.
Gli umani hanno la capacità di ragionare sulle proprie azioni e arrivare a un’etica sostenibile. La motivazione principale a favore dello xenotrapianto, alla fine dei conti, è la carenza di organi da trapiantare.
A queste tre questioni si aggiunge quella normativa. “La situazione italiana, con le continue proroghe al divieto di sperimentazione, sono frutto di un compromesso tra un’esigenza ideologica e una realizzazione pratica. La legislazione dovrebbe invece fare un percorso di delibera comune con le parti in causa, e tenere conto del punto di vista della scienza sin dal principio. Credo che vietare tout court gli xenotrapianti sarebbe un grave errore, pur considerandoli solo per casi selezionati”, commenta Annoni.
La motivazione principale a favore dello xenotrapianto, alla fine dei conti, è la carenza di organi da trapiantare. “Ogni giorno, in Europa muoiono circa venti persone perché non abbiamo organi. Vuol dire 7 mila persone all’anno”, ricorda ancora Cozzi. A questo proposito, Annoni sottolinea che in Italia non si parla abbastanza di donare gli organi. “Spesso le opposizioni sono dovute a mancanza di informazioni o idee sbagliate (come dimostra il caso di Geraci Siculo). Con le tecniche attuali, gli organi di una persona possono salvare fino a sette vite”.
Gli umani hanno la capacità (il potenziale, almeno) di ragionare sulle proprie azioni e arrivare a un’etica sostenibile. “Ogni ricerca ha la possibilità di essere condotta in modo etico, ma è importante esaminare la questione morale”, mi dice Annoni. “Ho seguito il percorso dello xenotrapianto in questi anni”, commenta infine Cozzi. “Ho visto una strada impegnativa, da prendere con cautela e su pazienti selezionati; un grande investimento che potrebbe portare a qualcosa di buono”.