


S ebbene Fourier avesse capito che l’assorbimento dell’energia termica rilasciata dalla superficie verso l’esterno fosse alla base di quello che chiamiamo effetto serra, non avanzò ipotesi sul meccanismo esatto che lo regola. Né fornì stime quantitative al riguardo.
L’indagine quantitativa dell’effetto serra ebbe inizio con il fisico irlandese John Tyndall, nato più o meno quando Fourier iniziava a interrogarsi su cosa regolasse la temperatura terrestre. Verso la metà del diciannovesimo secolo, insieme a un collega docente in un collegio inglese, decise saggiamente di trasferirsi in Germania per proseguire gli studi. Le università tedesche erano molto migliori di quelle britanniche nelle scienze sperimentali a quel tempo. Quando fece ritorno nel 1851, era pronto per una carriera nella chimica sperimentale e nella fisica: i suoi primi lavori riguardarono il magnetismo, uno degli argomenti di maggior interesse all’epoca. Nel 1853 ottenne un posto da professore alla Royal Institution, guidata da Michael Faraday, uno dei più grandi fisici sperimentali del diciannovesimo secolo, i cui lavori sono alla base della moderna teoria elettromagnetica. Un decennio più tardi, al pensionamento di Faraday, Tyndall fu nominato suo successore.
La passione per l’alpinismo e la glaciologia portarono Tyndall a indagare gli effetti di riscaldamento dovuti alla luce solare e a studiare i primi lavori di Fourier e altri che suggerivano che l’assorbimento negli infrarossi da parte dell’atmosfera causasse il riscaldamento della superficie terrestre. Da buon sperimentale, nel 1859 Tyndall iniziò una serie decennale di esperimenti sull’assorbimento di radiazione termica da parte di gas differenti.
A metà Ottocento i lavori di Fourier e Tyndall (e anche Claude Pouillet) dimostrarono che l’effetto serra era in grado di innalzare la temperatura della Terra.
Iniziò nel maggio di quell’anno con un apparato consistente di una sorgente di calore nota, un tubo contenente il gas da studiare, e in fondo al tubo un oggetto chiamato termopila che convertiva l’energia termica in un segnale elettrico rilevabile. Misurando l’energia termica proveniente dal tubo, riuscì a determinare quanta energia veniva assorbita dal gas.
Per inciso, questa è una delle prime applicazioni della spettroscopia di assorbimento, ovvero lo stesso strumento che Keeling utilizzò, a rovescio, per misurare con precisione la frazione di CO2 nell’atmosfera. Tyndall contribuì per primo a determinare le proprietà di assorbimento della CO2 e il suo lavoro fu seguito da un secolo di studi sempre più raffinati. Quando Keeling fece le sue misure, fu in grado di confrontare l’assorbimento di radiazione infrarossa da parte di campioni atmosferici con le proprietà di assorbimento di campioni di prova con percentuali di CO2 predeterminate, in modo da ottenere la percentuale di CO2 atmosferica. Un secolo prima, invece, Tyndall utilizzò il proprio metodo per inventare un sistema di misura, ancora oggi un uso, della percentuale di CO2 nel respiro umano.
Tornando a Tyndall, alla fine di maggio egli espose entusiasta i suoi risultati alla Royal Society:
Fatta eccezione per la celebre monografia di M. Pouillet sulla radiazione solare attraverso l’atmosfera, nulla, che io sappia, è stato pubblicato sulla trasmissione di calore radiante attraverso corpi gassosi. Nulla sappiamo neanche dell’effetto dell’aria sul calore irradiato dalla superficie terrestre.
Il 10 giugno espose con chiarezza i principi fisici sperimentali dell’effetto serra. Come disse nel corso di un seminario sul calore proveniente dal sole presso la Royal Society:
quando il calore viene assorbito dal pianeta, cambia in qualità e i raggi emessi dal pianeta non raggiungono lo spazio altrettanto liberamente. Dunque l’atmosfera permette l’ingresso del calore solare ma ne controlla l’uscita, e il risultato è una tendenza ad accumulare calore nei pressi della superficie del pianeta.
Tyndall studiò l’assorbimento nell’infrarosso da parte di azoto, ossigeno, vapor d’acqua, anidride carbonica, ozono, metano e altri gas presenti in atmosfera, e fu il primo a fornire misure quantitative. Il risultato principale è che i gas più importanti, ossigeno e azoto, non presentano un assorbimento significativo, mentre il vapor d’acqua è l’assorbitore di radiazione infrarossa più potente nell’atmosfera. Egli dimostrò anche che i gas che assorbono radiazione infrarossa sono anche degli emettitori, enunciando, come abbiamo visto, un altro principio chiave dell’effetto serra.
C’è una ragione molto semplice per cui le molecole di O2 e N2 non assorbono molta radiazione infrarossa, a differenza delle molecole di CO2 e H2O. L’assorbimento avviene quando la radiazione incidente è in grado di eccitare la vibrazione delle molecole. Per O2 e N2, si ha una situazione simile alla figura qui sotto, dove gli atomi vibrano avanti e indietro.
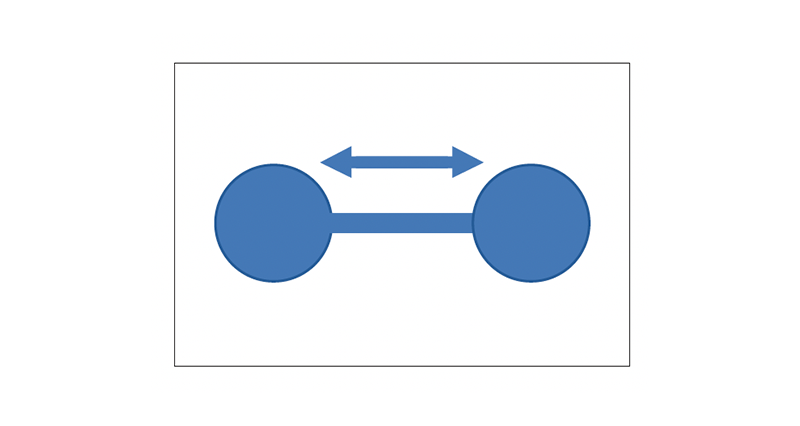
Queste vibrazioni sono molto rapide: di conseguenza, solo la radiazione ad alta frequenza (come la radiazione ultravioletta, per esempio) sarà in grado di eccitare le vibrazioni. Dunque questi gas assorbono gran parte delle radiazioni ultraviolette dannose provenienti dal Sole. Per CO2 e H2O, invece, si ha una situazione simile alla figura seguente.
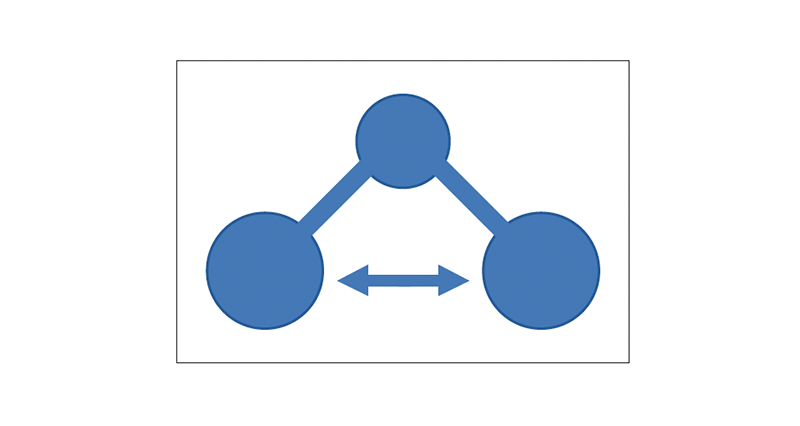
Questo tipo di vibrazione flettente è più lento, e dunque radiazioni infrarosse di frequenza minore sono in grado di eccitarle. Per questo motivo CO2 e H2O assorbono principalmente nell’infrarosso. Con i risultati di Tyndall, alla fine degli anni Sessanta dell’Ottocento, le basi sperimentali dell’effetto serra erano in gran parte dimostrate. Il lettore avveduto, tuttavia, noterà che la CO2 non ha ancora giocato un ruolo essenziale. Tyndall aveva mostrato, al contrario, che era il vapor d’acqua a dominare il riscaldamento terrestre, anche se piccoli quantitativi di idrocarburi e CO2 potevano in ogni caso avere un effetto significativo. (Incidentalmente, il vapor d’acqua è stato inizialmente responsabile del caldo infernale su Venere e sarà responsabile di un effetto serra devastante sulla Terra tra circa due miliardi di anni, quando la luminosità solare sarà aumentata di circa il 15%. Il risultante aumento delle temperature farà evaporare gli oceani, incrementando il vapor d’acqua nell’atmosfera e innescando un ulteriore riscaldamento, che causerà ancora maggiore evaporazione, e così via. A quel punto, la temperatura superficiale della Terra sarà simile a quella di Venere oggi, ovvero superiore ai 450 °C, abbastanza alta da fondere il piombo).
Entra in scena Svante August Arrhenius, chimico fisico e primo premio Nobel svedese nel 1903. Il lavoro che gli è valso il premio consistette nel dimostrare che, quando i sali si sciolgono in acqua, si separano in particelle cariche che Faraday aveva chiamato ioni. In seguito dimostrò che la maggior parte delle reazioni chimiche ha bisogno di energia termica per superare una barriera energetica, che altrimenti impedirebbe alle differenti molecole di interagire, e sviluppò un’equazione che porta ancora il suo nome e descrive una relazione tra questa “energia di attivazione” e i tassi di reazione. Inoltre scrisse dei lavori fondamentali per il primo sviluppo della biochimica e propose perfino la teoria oggi nota come panspermia, che suggerisce che la vita sia arrivata sulla Terra trasportata da spore provenienti da pianeti dove era già presente.
Non era certamente un fannullone. Ma sembra aver suscitato l’irritazione dei colleghi fin dai suoi esordi come studente. La sua tesi di dottorato, contenente il nucleo dell’idea per la quale ricevette poi il premio Nobel, fu valutata di “terza categoria” dai suoi docenti, e questo solo dopo che egli ebbe discusso la tesi riuscendo a migliorare la precedente valutazione di “quarta categoria”. Diventò professore all’Università di Stoccolma, ma solo dopo aver superato l’opposizione dei suoi colleghi, e fu eletto membro dell’Accademia Svedese delle Scienze nel 1901 dopo un ulteriore parere contrario dei colleghi.
Ad ogni modo, superò molto bene le contrarietà. Diventò rettore dell’Università di Stoccolma nel 1896 e, in seguito, dello stesso Nobel Institute. Mi sembra curioso il fatto che egli contribuì a fondare l’istituto e il premio stesso, fu membro dei Comitati del Nobel per la Fisica e la Chimica, e poi due anni più tardi fu il primo scienziato svedese a ricevere il Nobel. In ogni caso, anche se non è possibile escludere una qualche forma di nepotismo, i suoi contributi alla chimica e alla fisica sono stati certamente importanti e duraturi.
Nel 1896 Arrhenius applicò le sue notevoli capacità di chimico fisico al problema del cambiamento climatico. Conosceva i lavori di Fourier e Tyndall (e anche Claude Pouillet) che dimostravano che l’effetto serra era in grado di innalzare la temperatura della Terra. Il problema fisico che stimolava il suo interesse era la comparsa e scomparsa delle ere glaciali. Come scrisse efficacemente nel suo rivoluzionario lavoro del 1896, “On the influence of carbonic acid in the air upon the temperature of the ground”, pubblicato nel Philosophical Magazine and Journal of Science,
Non avrei certo effettuato calcoli così tediosi, se non fossero così straordinariamente interessanti. All’interno della Physical Society di Stoccolma, ci sono state discussioni molto animate sulle probabili cause delle Ere Glaciali: queste discussioni hanno portato, a mio avviso, a concludere che non esista ancora un’ipotesi soddisfacente che riesca a spiegare come le condizioni climatiche di una glaciazione possano realizzarsi in un tempo così breve come quello trascorso dall’ultimo periodo glaciale.
Dunque si dedicò ad approfondire come eventuali variazioni periodiche dell’atmosfera potessero modificare l’effetto serra e, di conseguenza, la temperatura terrestre su “piccoli” intervalli di tempo. Ovviamente era interessato a capire se variazioni abbastanza ampie da modificare il clima potessero essere causate da processi naturali sulla superficie terrestre. Tradusse in inglese il lavoro misconosciuto del collega Arvid Högbom, che paragonò la percentuale di CO2 (all’epoca chiamata acido carbonico, con riferimento alla sostanza che si forma quando la CO2 si scioglie in acqua) nell’atmosfera al quantitativo di carbonio immagazzinato negli organismi viventi.
Penso che quello di di Högbom sia un meraviglioso esempio di “stima di ordine di grandezza”. Argomenti di questo tipo sono molto importanti e potenti in fisica, poiché ci permettono di capire immediatamente quali sono i fattori cruciali su cui concentrarsi e quali sono invece quelli irrilevanti. Per questo motivo, riporto fedelmente la sua discussione:
Nell’ipotesi che la quantità media di acido carbonico nell’aria raggiunga una frazione volumica pari a 0,03 [Nota mia: questo valore è in ottimo accordo con l’attuale stima che la CO2 rappresentava lo 0,03% dell’atmosfera nel 1900], questo numero equivale allo 0,045% in peso, oppure a 0,342 millimetri di pressione parziale, o ancora a 0,466 grammi di acido carbonico per ogni centimetro quadro di superficie terrestre. Trasformata in carbonio, questa quantità formerebbe uno spessore di un millimetro al di sopra dell’intera superficie terrestre. La quantità di carbonio compresa nel mondo organico non può certamente essere stimata con la stessa precisione, ma è evidente che deve essere dello stesso ordine di grandezza, in modo che il carbonio nell’aria non possa considerarsi né molto più né molto meno abbondante rispetto a quello contenuto negli organismi. Considerando l’estrema rapidità con cui avvengono le trasformazioni nel mondo organico, tale quantità di acido carbonico disponibile non è eccessiva al punto che cambiamenti nella velocità e nell’entità delle trasformazioni, innescati da cause climatiche o altre, non siano in grado di generare spostamenti dall’equilibrio.
Può anche essere vecchio di cento anni, ma resta un ragionamento meravigliosamente semplice e potente basato sugli ordini di grandezza. Dimostra che la CO2 atmosferica globale può, in linea di principio, essere influenzata in modo significativo dai sistemi viventi su scale temporali biologiche e non geologiche. Sono felice di averne appreso l’esistenza mentre cercavo materiale.
La prima cosa che Arrhenius fece fu usare saggiamente le osservazioni della Luna a infrarossi effettuate da Samuel Pierpont Langley per calcolare quanta radiazione viene assorbita dalla CO2 e dal vapor d’acqua nell’atmosfera. Si concentrò sulla CO2 e sul vapor d’acqua in parte perché Tyndall aveva evidenziato che, anche se il vapor d’acqua era il gas serra principale, la CO2 e altri gas potevano avere comunque un impatto. in più, i ricercatori che vennero dopo Tyndall ipotizzarono che la CO2 giocasse un ruolo più importante rispetto a quello che Tyndall le accordava. Arrhenius giunse alla tabella di assorbimento che riproduco qui sotto perché la mole di lavoro che richiese fu considerevole.

Mi ci è voluto un po’ di tempo per capire le sue unità di misura. Per la CO2 si tratta di unità relative: “1” indica la quantità di CO2 che incontrerebbe un raggio di luce che attraversa verticalmente l’atmosfera e passa attraverso la più piccola massa d’aria. Le unità per il vapor d’acqua sono un po’ più standard: “1” indica la quantità di vapor d’acqua attraversato da un raggio di luce verticale in corrispondenza di una umidità pari a 10 grammi per metro cubo nei pressi della superfi cie terrestre, che egli stimava fosse l’umidità media dell’aria. si noti che Arrhenius stimava dunque che a quel tempo circa il 70% della radiazione infrarossa emessa verticalmente verso l’alto fosse assorbita.
Usò questi dati e, sfruttando argomenti di radiazione all’equilibrio simili a quelli descritti nel capitolo precedente, calcolò come la temperatura di superficie all’equilibrio dovesse cambiare al variare della concentrazione di CO2. Sotto diversi aspetti, i suoi modelli erano decisamente più complessi di quanto descritto in precedenza.
Per prima cosa, Arrhenius non postulava una temperatura uniforme dell’atmosfera e dimostrò esplicitamente qualcosa a cui ho accennato in precedenza, ovvero che una parte alta più fredda e una parte bassa più calda aumentano la temperatura superficiale perché gli strati alti emettono meno radiazione e il calore resta concentrato vicino al suolo. Tentò anche di incorporare gli effetti delle nuvole sulla temperatura facendo ricorso ai dati.
Infine, per quanto mi risulta, Arrhenius tenne conto esplicitamente dell’aumento di umidità assoluta (e dunque dell’aumento di assorbimento da parte del vapor d’acqua), che si osserva a latitudini dove si registrano temperature medie più elevate, nel determinare come una variazione di CO2 modifichi la temperatura superficiale, utilizzando nei suoi calcoli misure di temperatura e umidità in varie località. Non incluse, tuttavia, un effetto che può amplificare l’impatto dell’aumento di CO2 sulla temperatura. Per la precisione, poiché un aumento di concentrazione di CO2 produce un aumento delle temperature, può verificarsi una maggiore evaporazione e quindi un aumento del vapore nell’aria e, di conseguenza, un maggiore assorbimento nell’infrarosso da parte dell’atmosfera. Ma, come primo passo, si trattava di un risultato straordinario. La figura seguente mostra i suoi risultati che, sebbene risultino sovrastimati, non sfigurano sotto una lente odierna. Come si vede dalla tabella, per un incremento del 50% nella concentrazione di CO2 atmosferica egli stima un aumento relativamente uniforme di circa 3-3,5 °C, mentre per un raddoppio della CO2 predice un aumento di 5-6 °C. In ogni caso, stima un aumento di temperatura ai poli maggiore di quello all’equatore.
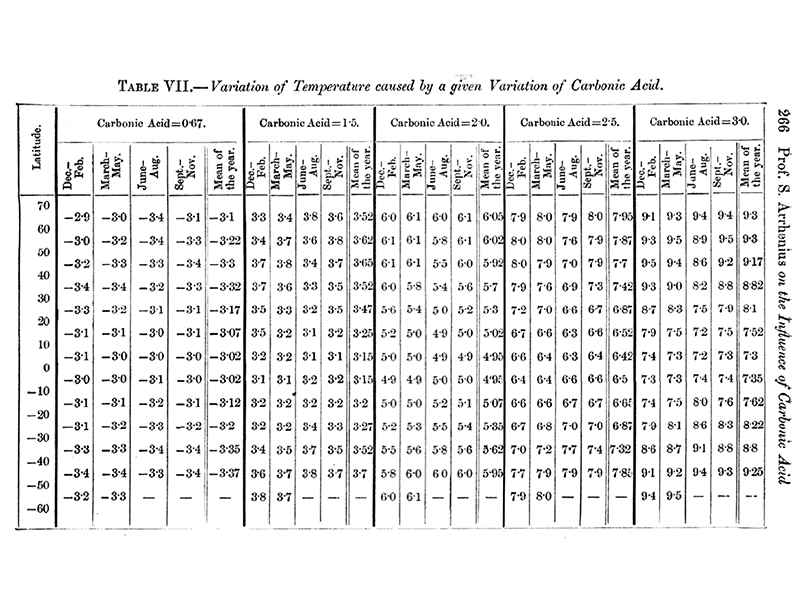
Essendo un fisico esperto, tuttavia, Arrhenius non si accontentava di una semplice tabella. Voleva derivare una legge generale. Lo fece interpolando i risultati nella tabella. È bene notare che le ultime tre colonne relative ai valori più alti di CO2 furono ottenute estrapolando i dati originali di Langley, in assenza di misurazioni dirette.
Detto questo, il risultato è evidente dalla tabella. Ci si attende un aumento regolare di circa 3 °C di temperatura ogni volta che la concentrazione di CO2 aumenta di un fattore 3/2. Come scrisse Arrhenius, “se la quantità di acido carbonico aumenta in progressione geometrica, l’aumento di temperatura seguirà all’incirca una progressione aritmetica”. Questo tipo di relazione, dove una quantità cresce linearmente mentre l’altra segue una legge di potenza – ovvero, di 3/2 tra 0,67 e 1, di (3/2)2 tra 0,67 e 1,5, e di (3/2)3 tra 0,67 e 2,25 – implica, dal punto di vista matematico, che la prima quantità (temperatura superficiale) varia come il logaritmo della seconda quantità (concentrazione di CO2).
Arrhenius non si limitò a estendere i limiti di validità dei dati di Langley con la sua estrapolazione, ma ignorò anche l’ammonimento di Langley a considerare quei dati con la dovuta cautela. In ogni caso, dopo un secolo di studi rivolti semplicemente a ricavare la temperatura media sulla superficie terrestre, l’obiettivo di Arrhenius di stabilire in che modo una modifica delle percentuali atmosferiche induca un cambiamento di temperatura era decisamente innovativo e ambizioso. E, ad essere onesti, egli usò i migliori dati e le migliori teorie disponibili a quel tempo. Come vedremo, il quadro generale dei suoi risultati è valido ancora oggi. Non male per un lavoro fatto nel 1896.
Curiosamente, anche se ad Arrhenius è normalmente attribuita la deduzione che le emissioni di CO2 da attività industriali umane sono potenzialmente grandi abbastanza da causare il riscaldamento del pianeta, il suo fondamentale lavoro non fu motivato da ciò, né egli ne fece menzione nella pubblicazione. Scrisse invece di essere spinto dall’interesse per l’origine e la conclusione delle ere glaciali, poiché sospettava che le variazioni di concentrazione di CO2 fossero in grado spiegare tali escursioni della temperatura terrestre. Tuttavia non riuscì a fornire un meccanismo preciso che spiegasse come la CO2 potesse variare della quantità richiesta su scale temporali geologiche.
Sapeva in ogni caso, grazie al suo collega Arvid Högbom, che il consumo di carbone a quel tempo – circa cinquecento milioni di tonnellate all’anno – era responsabile dell’emissione di circa un millesimo della CO2 allora presente nell’atmosfera. Högbom pensò che tale contributo aggiuntivo fosse facilmente compensato dalla formazione di carbonati tramite processi alterativi sebbene, come descritto in precedenza, oggi sappiamo che tale formazione è bilanciata a livello geologico dalle emissioni di CO2 di origine vulcanica. È interessante notare che, se si prende la stima di Högbom e si ipotizza una combustione di carbone continua al tasso da egli suggerito per circa un secolo, la concentrazione di CO2 atmosferica aumenterebbe di circa il 10%, nell’ipotesi che essa rimanga interamente nell’atmosfera. Questo è più o meno l’aumento che si verificò tra il 1750 e il 1900 (da 275 a 300 ppm) come si può vedere dalle curve di Keeling.
Ad Arrhenius è normalmente attribuita la deduzione che le emissioni di CO2 da attività industriali umane sono grandi abbastanza da causare il riscaldamento del pianeta; ma il suo fondamentale lavoro non fu motivato da ciò, né egli ne fece menzione nella pubblicazione.
In un seminario pubblico che Arrhenius diede pochi anni dopo l’uscita del suo articolo scientifico, egli non esitò a estrapolare la stima di Högbom nel futuro. Tenendo conto dell’assorbimento della CO2 da parte degli oceani, stimò che, mantenendo quel tasso di consumo di combustibili fossili, la concentrazione di CO2 nell’atmosfera sarebbe raddoppiata nel giro di tremila anni, e le temperature globali sarebbero aumentate di 3-4 °C. Egli considerava questa eventualità una benedizione per il genere umano. Non solo si sarebbe evitata una ulteriore era glaciale, ma “i nostri discendenti, anche se solo nel lontano futuro, vivrebbero sotto un cielo più caldo e in un ambiente meno ostile di quello che ci è stato concesso”. Da abitante della Scandinavia, considerava il riscaldamento globale una prospettiva decisamente favorevole!
Arrhenius elaborò queste idee in due libri scritti nel decennio successivo, che gli valsero la reputazione odierna di primo scienziato ad aver predetto il riscaldamento globale di origine antropica. Il povero Högbom, le cui stime fornirono le basi per le predizioni di Arrhenius, è finito nel dimenticatoio.
Crediti a parte, Arrhenius fu il primo a costruire un modello di derivazione empirica che permette di capire quanto il clima sia sensibile alle variazioni nell’abbondanza di molecole la cui concentrazione atmosferica sia minore di una parte su mille: qualcosa che, in assenza di sufficiente competenza, può sembrare assurdo. Per questo, e per il fatto che sia le caratteristiche essenziali del modello sia le sue predizioni restano ancora attuali, egli merita di essere ricordato.
Estratto da La fisica del cambiamento climatico (Raffaello Cortina Editore, 2022).